通用名:瑞戈非尼
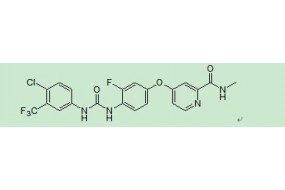
英文名:Regorafenib
商品名:Stivarga
申报类型:3+3
剂型及规格:片剂,40mg
适应症:转移性结直肠癌
二、项目介绍
2012年9月27日,FDA批准了口服药物Regorafenib(Stivarga,拜耳)治疗转移性结直肠癌。Regorafenib是一种新型的多激酶抑制剂,阻断促进肿瘤生长的多种酶。
FDA药物评价和研究中心血液和肿瘤学办公室主任Richard Pazdur博士在发布会上指出,Regorafenib是最近的结直肠癌治疗药物,被证明可以延长病人的生命,在过去两个月来是第二个被批准治疗结直肠癌的药物。8月份,阿柏西普(Zaltrap,赛诺菲- 安万特)被FDA批准联合FOLFIRI应用。
Regorafenib被批准时同时带有黑框警告,指出可能有严重或致命性的肝毒性。
在这项药物的关键性3期随机试验中,被称为CORRECT试验,Regorafenib组的中位总生存期为6.4个月,而安慰剂组为5.0个月。生存期增加了29%,最初是在2012的胃肠道肿瘤研讨会中报告,这是第一个小分子激酶抑制剂被证明对转移性结直肠癌有效。
在CORRECT研究中,除了标准治疗外,505名病人被随机分配口服Regorafenib 160mg,255名病人进入安慰剂组。患者持续治疗直到疾病进展,死亡或是出现不可耐受的毒性。除了总生存期改善外,中位无进展生存期也得到改善(2.0 vs 1.7个月),HR为0.493(P<0.000001)。疾病控制率也同样如此(44% vs 15%,P<0.000001)。
知识产权:化合物专利2020年到期。
三、项目进度:
原料合成已完成中试,制剂处方已完成,其他临床前研究进行中,转让方式可来电来函咨询并索取项目详细资料
英文名:Regorafenib
商品名:Stivarga
申报类型:3+3
剂型及规格:片剂,40mg
适应症:转移性结直肠癌
二、项目介绍
2012年9月27日,FDA批准了口服药物Regorafenib(Stivarga,拜耳)治疗转移性结直肠癌。Regorafenib是一种新型的多激酶抑制剂,阻断促进肿瘤生长的多种酶。
FDA药物评价和研究中心血液和肿瘤学办公室主任Richard Pazdur博士在发布会上指出,Regorafenib是最近的结直肠癌治疗药物,被证明可以延长病人的生命,在过去两个月来是第二个被批准治疗结直肠癌的药物。8月份,阿柏西普(Zaltrap,赛诺菲- 安万特)被FDA批准联合FOLFIRI应用。
Regorafenib被批准时同时带有黑框警告,指出可能有严重或致命性的肝毒性。
在这项药物的关键性3期随机试验中,被称为CORRECT试验,Regorafenib组的中位总生存期为6.4个月,而安慰剂组为5.0个月。生存期增加了29%,最初是在2012的胃肠道肿瘤研讨会中报告,这是第一个小分子激酶抑制剂被证明对转移性结直肠癌有效。
在CORRECT研究中,除了标准治疗外,505名病人被随机分配口服Regorafenib 160mg,255名病人进入安慰剂组。患者持续治疗直到疾病进展,死亡或是出现不可耐受的毒性。除了总生存期改善外,中位无进展生存期也得到改善(2.0 vs 1.7个月),HR为0.493(P<0.000001)。疾病控制率也同样如此(44% vs 15%,P<0.000001)。
知识产权:化合物专利2020年到期。
三、项目进度:
原料合成已完成中试,制剂处方已完成,其他临床前研究进行中,转让方式可来电来函咨询并索取项目详细资料





 您还没有登录,请登录后查看联系方式
您还没有登录,请登录后查看联系方式 发布供求信息
发布供求信息 推广企业产品
推广企业产品 建立企业商铺
建立企业商铺 在线洽谈生意
在线洽谈生意

